Ein mit der Entstehung von Tumoren zusammenhängendes Protein kann unter normalen Umständen Fehler während der Zellteilung korrigieren, die anderenfalls zu Krebs oder anderen Krankheiten führen könnten, nach einer neuen Studie von Wissenschaftlern der Universität Rockefeller, die in der Zeitschrift Nature Cell Biology.
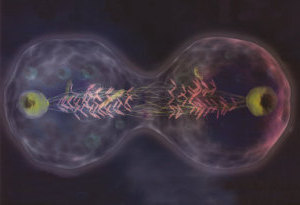
Die Ergebnisse zeigen, dass das Protein, ein Enzym namens Aurora Quinasa, gegen die anormale Sekretion von Chromosomen agiert, welche bei der Zellteilung entstehen kann. Die Forscher, unter der Leitung von Tarun Kapoor, Assistenzprofessor und Leiter des Labors für Chemie und Zellbiologie der Universität Rockeflller, identifizierten die Rolle des Proteines Aurora Quinasa bei der Aktivierung und Deaktivierung des Proteins in lebenden Zellen durch Nutzung von kleinen organischen Molekülen und Studium der Reaktionen.
"Die generelle Aktivierung der Cineasen ist bisher experimentell nicht möglich gewesen, weil ein einmal deaktiviertes Protein nicht wieder aktiviert werden kann“, meint der Hauptautor Michael Lampson, Post-Doktorand am Labor für Chemie und Molekularbiologie der Universität Rockefeller. „Diese Experimente zeigt, wie die Aktivierung und Deaktivierung der Funktionen der Proteine über genetische Chemie ein wertvoller Ansatz zum Verständnis der Zellmechanik sein kann“.
„Die Aurora Quinasa Proteine sind nun als Ziele für die Medikamente validiert, die man bei der Krebsbehandlung einsetzt“, fügt Kapoor hinzu. „Unser Ziel ist es, diese Moleküle als Medikamente zu nutzen, um über die Grundmechanismen bei der Zellteilung zu lernen und auch für ein besseres Verständnis der Folgen der Blockadefunktion des Proteins Aurora Quinasa bei den Zellen der Wirbeltiere“.
Wenn sich die Zellen teilen, muss sich die Ausgangszelle selbst vervielfältigen und mit exakter Präzision jedes ihrer 46 Chromosomen aussondern, sodass die Tochterzellen die gesamte genetische Information mit erben. Während der normalen Zellteilung verbindet sich jedes kopierte Chromosomenpaar mit einer Bipolaren Struktur namens Huso Miotico, das aus Protein-Polymeren besteht, die man unter dem Begriff Mikrotuboulen kennt. Für jedes kopierte Paar fügt sich ein Geschwisterchromosom an ein Ende der Achse und das andere an das entgegengesetzte Ende. Wenn sich die Zelle teilt, werden die Geschwisterchromosome getrennt und in entgegengesetzte Richtung ausgeschieden, sodass jede Tochterzelle eine exakte Kopie des verdoppelten Chromosoms bekommt.
Wenn Fehler in diesem Prozess entstehen, bekommen die Tochterzellen nicht alle Gene, sodass es zu Mißbildungen bei der neuen Zelle kommt und weiter zu Krankheiten wie Krebs im Körper. Einer dieser Fehler entsteht beispielsweise, wenn beide Geschwisterchromosome eines verdoppelten Paares sich an dem gleichen Ende des Huso miotico bei der Zellteilung anheften. Das Ergebnis ist, dass beide Chromosome in der gleichen Tochterzelle landen, und dafür eine andere Tochterzelle in Chromosom weniger enthält.
Fehlerhafte Zellteilung vermeiden: das Protein Aurora Quinasa
Um dieser Frage nachzugehen, nutzten die Forscher kleine organische Moleküle, um den Vorgang der Zellteilung zu stören. Diese Inhibitoren dringen in die Zellmembran ein und blockieren die Aktion von mehreren Proteinen.
Die Wissenschaftler haben festgestellt, dass ohne Aurora Quinasa, die Chromosomen sehr anfällig für eine ungünstige Verbindung während der Zellteilung sind. Aber ihre Rolle bei der Korrektur dieser falschen Verbindungen der Proteine war bisher nicht bekannt. Um diesen Mechanismus zu verstehen, nutzen Lampson und Kollegen ein kleines Molekül, das als Inhibitor des Aurora Quinasa bekannt ist, das AKI-1, das ursprünglich von dem Pharmaunternehmen AstraZeneca entwickelt wurde und die Aktivität von Aurora Quinasa hemmt.
Die Forscher am Institut für Molekular-Pathologie in Wien hatten darauf hingewiesen, dass die Aktivität des Proteins Aurora Quinasa für die Spaltung der defekten Verbindungen verantwortlich sein könne und dadurch neue korrekte Verbindungen unterstütze. Lampson entwarf eine Strategie zur Bestätigung dieser These, in dem er Zellen mit dem Hemmfaktor für Aurora Quinasa züchtet, um damit Verbindungsfehler der Chromosomen zu provozieren die dann an dem gleichen Pol des bipolaren Huso Miotic andocken würden. Mithilfe eines Ultramikroskops in Echtzeit, aktivierten Lampson und Kollegen das Protein Auora Quinasa und beobachteten die Folgen.
Nur wenige Minuten später trat ein unerwartetes Ereignis ein.
„Sobald wir den Inhibitor des Proteins Aurora Quinasa entfernten, verringerten sich die Fasern der Mikrotuboulen und die Chromosomen bewegten sich direkt an ein Ende des bipolaren Husos,“ erzählt Lampson.
Nach Lampson, entfernt das Protein Aurora Quinasa die Fasern des Mikrotubuls, sodass sie zerfallen. Wenn sie zerfallen, werden die Chromosomen an die Enden ausgestoßen, und gleichzeitig damit können sie sich an ein Mikrotubulus des entgegengesetzten Endes verbinden. Sobald das Chromosom an beiden Polen verbunden ist, kann man es korrekt anordnen.
„Dies ist ein unerwarteter Mechanismus“, sagt Lampson. „Er zeigt wie die Proteine Aurora Quinasa die Mikrotuboulen steuern, um Fehler zu korrigieren“.
Neben Lampson und Kapoor, sind Mitautoren der Studie Kishoer Renduchital der Universität Rockefeller und Alexey Khodjakov des Wadsworth Centers des New York State Department of Health.
Die Forschung wurde von dem National Institute of Health gefördert.
Weitere Artikel zu Krebserregendes Protein korrigiert die Zellteilung
 |  |  |
| Terminationsphase der Proteinbiosynthese | G-Proteine | Zerstörung der amyloiden Proteine durch Laser |